Interazione chimica tra alluminio e alimenti
In questa sede, a partire dalla chimica di base, si affronta il tema dell’interazione tra alluminio e alimenti, portando dati numerici frutto di sperimentazioni eseguite con rigore.
Si conferma che l’approccio normativo italiano, sancito dal DM 76 del 18/04/2007 tutela i consumatori e fornisce chiare indicazioni per evitare usi impropri. Si auspica che altri paesi europei possano seguire l’esempio legislativo italiano.
Ciro Sinagra

L’Alluminio come elemento chimico, ossia quello che indichiamo con il simbolo Al nella Tavola Periodica degli Elementi, non è disponibile in natura.
Per ottenerlo, occorre effettuare l’elettrolisi dell’allumina (o ossido di alluminio, Al2O3, composto presente in elevate quantità in natura dato che si tratta del terzo componente della crosta terrestre) in Na3AlF6, fluoroalluminato di sodio, con un grande dispendio energetico (ca 16 kWh/kg): non è semplice separare l’alluminio dal suo ossido.
L’alluminio elementare è un anfotero (si può comportare da acido o da base in funzione dell’ambiente in cui si trova), ha un’altissima reattività - bassa energia di ionizzazione - e tende subito a combinarsi con l’ossigeno atmosferico per diventare nuovamente, in pochi minuti, ossido (Al2O3); in soluzione acquosa si idrolizza, diventando idrossido (Al(OH)3) o reagisce con acidi per diventare, almeno in parte, un sale.
Ciò significa che parlare di migrazione di Alluminio non è completamente corretto: dovremmo infatti parlare di migrazione di ioni di alluminio e dei composti di alluminio già presenti sulla superficie del metallo (ossido) o composti che si formano a contatto con l’ambiente di reazione. Quando, mediante un’analisi chimica (effettuata per esempio per assorbimento atomico o ICP) andiamo a determinare l’Alluminio, in realtà determiniamo la quantità di Alluminio totale, ossia anche l’alluminio contenuto in qualsiasi suo composto.
CENNI TEORICI
Uno studio effettuato da P. Dumas, J. Dubarry-Barbe, D. Rivière, Yves Levy e J. Corset sulle cinetiche di formazione dell’ossido di alluminio a temperatura ambiente [1] dimostra che bastano soli 10 minuti affinché l’alluminio sia ricoperto da uno strato di ossido protettivo di spessore compreso tra 2 e 4 nanometri, quello che naturalmente si trova sulla superficie di qualsiasi manufatto in alluminio (figura 1).
L’ossidazione dell’alluminio a temperatura ambiente e pressione standard è stata studiata mediante esperimenti di Riflessione Totale Attenuata (ATR), in particolare viene riportato l’andamento dell’angolo di minima riflessione, θmin, nel tempo di esposizione all’aria.
Come evidenziato in figura 1, dopo circa 10 minuti di esposizione, il valore dell’angolo tende a stabilizzarsi, il che corrisponde all’avvenuta formazione di circa 3 nm di ossido di alluminio in superficie. Quindi in superficie, su qualsiasi manufatto in alluminio o sua lega non rivestito, abbiamo dell’ossido.
Tale ossido, in un certo range di pH (Diagramma di Pourbaix, figura 2), protegge l’alluminio dalla corrosione.
Quando il metallo si trova in ambienti a pH fortemente acidi o basici, tale ossido non riesce da solo a proteggere dalla corrosione il substrato metallico, che quindi si solubilizza. formando composti che dipendono dall’ambiente di reazione.
In particolare, per pH <3.9 (ambienti fortemente acidi, principale oggetto della discussione) l’alluminio si corrode e va continuamente in soluzione come ione Al3+, che successivamente si lega ai complessanti presenti nello specifico alimento per formare complessi (citrati, lattati, acetati) [2].
L’alluminio ad alta purezza (99,90%) non avrebbe caratteristiche meccaniche sufficienti per la produzione di vaschette o foglio di alluminio, per i quali normalmente vengono usate leghe di alluminio da lavorazione plastica.
I fenomeni corrosivi possono essere amplificati dalla presenza di metalli diversi dall’alluminio con conseguente generazione di fenomeni di natura galvanica.
Quasi tutti gli elementi chimici usati come alliganti per produrre leghe di alluminio hanno potenziali elettrochimici più alti dello stesso alluminio: in presenza di acqua, ossigeno ed elettroliti, si sviluppano pertanto fenomeni galvanici, che prevedono trasporto di energia e materia: risultando meno nobile, l’alluminio si comporta di conseguenza come elemento sacrificale, corrodendosi.
Ad esempio, il magnesio è uno dei pochi elementi che ha un potenziale elettrochimico più basso di quello dell’alluminio e si ossida pertanto più velocemente, aumentando la protezione dell’alluminio dalla corrosione:
Mg2+ + 2e- → Mg -2,37
Al3+ + 3e- → Al -1,66
Viceversa, il ferro ha un potenziale più alto, pertanto l’alluminio risulta sacrificale:
Fe2+ + 2e- → Fe -0,44
Sperimentazione in laboratorio: prove di migrazione su laminati di diverse leghe di alluminio in cloruro di sodio e acido citrico (ICP e analisi SEM)
La corrosione - ma anche il rilascio/migrazione - dell’Alluminio in ambiente fortemente acido è stata oggetto di studi sia per le diverse leghe di alluminio utilizzate, sia mettendo a contatto il metallo con diverse tipologie di alimenti. È consuetudine che molti alimenti acidi e salati, soprattutto quelli che devono avere una lunga shelf life, vengano confezionati e conservati in packaging di alluminio protetto da rivestimenti polimerici: basti pensare alle lattine per bibite, alle scatole per carne o pesce, a contenitori semirigidi per marmellate, composte e purea di frutta, ecc.
Uno degli studi è stato condotto anche nel laboratorio R&D di Laminazione Sottile SpA mediante prove di migrazione su laminati di diverse leghe di alluminio, nude (non rivestite) a contatto con soluzioni acquose di cloruro di sodio (3,5% in peso) e acido citrico monoidrato (1,0% in peso, pH = 2.01) a temperatura ambiente per tempi da 3 a 72 ore.
Le tecniche analitiche utilizzate - Spettrometria di Emissione su Plasma (ICP) e Microscopio Elettronico a Scansione (SEM) - hanno evidenziato che:
- fino a 24 ore di contatto con le soluzioni di prova, gli attacchi sul metallo risultano modesti (figura 3);
- più elevata è la purezza del metallo, meno aggressivo è l’attacco delle soluzioni;
- il cloruro di sodio genera pitting (figure 4a e 5a), l’acido citrico genera corrosione filiforme ai bordi dei grani (figure 4b e 5b).
Le figure 4 e 5 evidenziano il diverso comportamento a corrosione delle leghe in ambiente acido e salino: a parità di condizioni, una lega 1200 si corrode molto meno rispetto a una 8006.

Figure 1 e 2 (Click to enlarge)
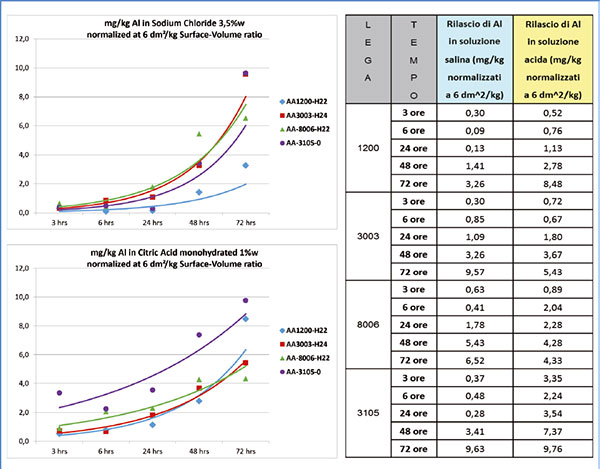
Figura 3 (Click to enlarge). Test di ICP su diverse leghe di alluminio in cloruro di sodio e acido citrico a temperatura ambiente.
La confutazione, dati alla mano
Occorre quindi sottolineare che effettuare test in condizioni di rischio, come riportato da The Federal Institute for Risk Assessment (BfR) in “Bfr Forschung nachweis des Uebergangs von Aluminium aus Menueschalen in Lebensmittel” del 29/05/2017 [3] non comporta alcuna scoperta o novità rilevante: gli alimenti utilizzati per i test rappresentano standard al di sopra delle limitazioni d’uso stabilite nel DM 76 del 18/04/2007, indicate da tutti i produttori italiani di vaschette e foglio di alluminio per alimenti [4].
Al contrario, nessuna legislazione specifica è attualmente prevista in Europa. Pertanto, tali test non costituiscono alcuna prova né dell’accumulo né tantomeno della tossicità dell’alluminio, dal momento che le quantità riscontrate di alluminio migrato negli alimenti non trovano corrispondenza nell’uso reale che si fa dei contenitori di alluminio in questione: nessun contenitore in alluminio nudo può essere intenzionalmente prodotto per il contatto per tempi prolungati con alimenti che generano un ambiente fortemente acido a contatto con lo stesso.
È chiaro che il pH di una passata di concentrato di pomodoro è molto più critico rispetto a una pasta condita con la stessa salsa e i valori di rilascio dell’alluminio saranno del tutto diversi.
In Italia, gli studi e i test condotti dall’Istituto Superiore di Sanità, tra i primi laboratori pubblici a interessarsi dell’alluminio utilizzato come materiale e oggetti a contatto con gli alimenti (MOCA), hanno indotto il Ministero della Salute a normare la materia mediante il Decreto Ministeriale n. 76 del 18/04/2007, regolamento recante la disciplina igienica dei materiali e degli oggetti di alluminio (Allegato I) e di leghe di alluminio (Allegato II) destinati al contatto con gli alimenti.
In tale Decreto venivano indicate le condizioni proprie d’uso in termini anche di tempo e temperatura (refrigerazione) di utilizzo a tutela dei consumatori.
L’Allegato I, “Requisiti di purezza dell’alluminio”, si riferisce all’alluminio puro al 99%, poco utilizzato nella produzione di contenitori alimentari poiché non possiede le caratteristiche meccaniche sufficienti.
L’Allegato II, “Caratteristiche di composizione dei materiali e degli oggetti di leghe di alluminio ottenuti mediante trasformazione plastica”, si riferisce alle leghe di alluminio utilizzate normalmente per le vaschette e per il foglio di alluminio adibiti al contatto con gli alimenti.

Figura 4.a (click to enlarge) pitting generato dal cloruro di sodio su lega AA1200 H22 dopo 72 ore; b) corrosione filiforme ai bordi dei grani generata dall’acido citrico su lega AA1200 H22 dopo 72 ore.
Figura 5.a (click to enlarge) pitting generato dal cloruro di sodio su lega AA8006 H22 dopo 72 ore; b) corrosione filiforme ai bordi dei grani generata dall’acido citrico su lega AA8006 H22 dopo 72 ore.
Sperimentazione sugli alimenti: vaschette e foglio di alluminio per l’imballaggio alimentare
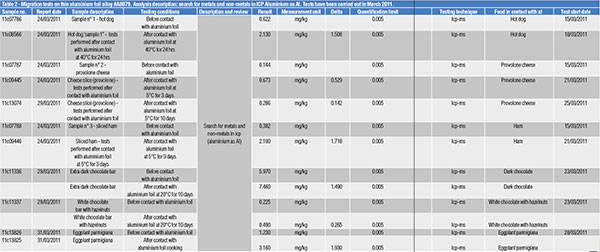
Uno studio, pubblicato nel 2014 da R. Bonacina e C. Sinagra, effettuato su vaschette e foglio di alluminio sottile usati per cottura e conservazione di diversi alimenti, quantificò e discriminò le quantità di alluminio già presenti nei diversi alimenti considerati e quelle “rilasciate” dal packaging [7].
Qui di seguito vengono riportati i valori, riscontrati mediante analisi ICP, su vaschette (tabella 1) e foglio (tabella 2) di alluminio.
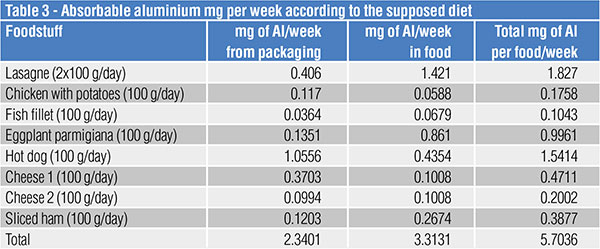
Una volta conosciute le quantità di alluminio totale, espresse in mg/kg di alimento, fu ipotizzata una dieta di ben 4.500 kcal/giorno costituita da cibi tutti cucinati e conservati esclusivamente in packaging di alluminio. Tale ipotesi, ovviamente estrema e senza alcuna attinenza a un uso reale dei packaging di alluminio, arrivò alle conclusioni indicate nella tabella 3.
In una settimana l’assorbimento totale era pari a 5,7 mg.
L’EFSA, nello studio “Safety of Aluminium from dietary intake: Scientific Opinion of the Panel on Food Additives, Flavourings, Processing Aids and Food Contact Materials (AFC)” - pubblicato su EFSA Journal 2008 754, 1.34 - consigliava di non superare 1 mg/kg peso corporeo a settimana (TWI) [8].
Ciò significa che una persona adulta, di peso corporeo pari a 60 kg, non dovrebbe immettere nella dieta più di 60 mg di Al a settimana. Il valore di 5,7 mg/settimana, sortito come somma assorbita mediante la dieta “estrema” ipotizzata, appare di tutta sicurezza.
I composti di Alluminio che si possono trovare negli alimenti e nei farmaci
Ossido di Alluminio Al2O3 - È un ossido ceramico, con una temperatura di fusione di 2050 °C, densità 3.94 g/cm3 e bassissima solubilità in acqua (circa 0.001 g/l a 20 °C).
Dato che l’ossido di Alluminio è il terzo componente della crosta terrestre (F. W. Clarke, dopo aver analizzato 1672 tipi diversi di rocce, lo ha classificato al secondo posto - dopo la silice SiO2 - stabilendo una percentuale in peso pari al 15.41%), l’esposizione dell’uomo verso di esso è molto elevata[5].
Se l’ossido di Alluminio rappresentasse un reale problema per la salute umana dovremmo decidere, come umanità, di “emigrare in massa” su un pianeta più ospitale della Terra (ammesso che esista)!
Vi sono numerose applicazioni dell’ossido di Alluminio: in emodialisi, in cementi per uso dentale, come abrasivo in paste dentifricie, come agente disperdente in additivi alimentari. È presente anche in alcuni preparati per uso topico come anti-acne.
Al2O3 LD50 >5.000 mg/kg peso corporeo nei ratti per via orale.
Idrossido di Alluminio Al(OH)3 - L’alluminio in acqua viene idrolizzato e forma l’idrossido di alluminio:
2Al + 6H2O → 2Al(OH)3 + 3H2.
L’idrossido di alluminio trova ampia applicazione nei farmaci ed è presente nei prodotti antiacidi (Alu-cap, Gaviscon, Pepsamar, Maalox ecc.): reagisce nello stomaco per ridurre il valore di acidità e, quindi, il rischio di ulcere, bruciori e dispepsia. Precipitati di idrossido di alluminio sono utilizzati come coadiuvanti in alcuni vaccini, per prevenire la precipitazione di alcune proteine e il loro accumulo sulle pareti del flacone durante lo stoccaggio del preparato.
Al(OH)3 LD50>5.000 mg/kg peso corporeo nei ratti per via orale.
Cloruro di alluminio AlCl3 - Si ottiene per reazione dell’alluminio con l’acido cloridrico: 2Al + 6HCl = 2AlCl3 + 3H2.
Anche il tricloruro di alluminio viene usato nella preparazione di farmaci utilizzati per via topica (epidermide), come astringente e antitraspirante. Viene usato nel trattamento di iperidrosi e bromidrosi plantare, planare e ascellare, ma anche nel trattamento del piede d’atleta, per favorire, e di conseguenza aumentare, l’efficacia dei farmaci antifungini specifici (micosi).
AlCl3 LD50 = 3.311 mg/kg peso corporeo nei ratti per via orale
Alluminio acetato Al(CH3COOH)3 - Si ottiene per reazione chimica tra alluminio e acido acetico:
2Al + 6CH3COOH = 2Al(CH3COO)3 + 3H2.
Vanta proprietà astringenti e antisettiche che si esplicano contro batteri, funghi (es. nel piede d’atleta) e anche virus (es. nel trattamento delle vescicole dell’Herpes Zoster); inoltre, può essere utilizzato per patologie eczematose o morsi di insetti.
Al(CH3COO)3 LD 50 = non disponibile
Alluminio solfato Al2(SO4)3 - Si ottiene per reazione tra l’alluminio e l’acido solforico: 2Al + 6H2SO4 → Al2(SO4)3 + 3SO2 + 6H2O.
Usato in farmacologia come emostatico locale per coagulazione del sangue e costrizione dei capillari; antitraspirante, in quanto riduce la sudorazione per costrizione dei pori della superficie cutanea; anti-congestionante, per la riduzione dell’irrorazione sanguigna a livello delle mucose.
È anche presente in additivi alimentari quali: E520 solfato di alluminio, E521 solfato di alluminio e sodio, E522 solfato di alluminio e potassio, E523 solfato di alluminio e ammonio.
Tutti i prodotti sopracitati sono composti di origine sintetica derivati dall’alluminio: si presentano sotto forma di cristalli trasparenti o polvere cristallina bianca, sono facilmente solubili in acqua e risultano insolubili in etanolo. Vengono usati per promuovere la precipitazione delle proteine, ad esempio durante il processo di produzione della birra. Contribuiscono inoltre a rafforzare la struttura dei vegetali durante la lavorazione. Possono essere contenuti in diversi alimenti, come ad esempio albume d’uovo in polvere, frutta e verdura candite e cristallizzate.
Al2(SO4)3 LD50 = 980 mg/kg peso corporeo nei ratti
Alluminio lattato C9H15AlO9 - Si può formare per reazione tra Alluminio e acido lattico:
6CH3CH(OH)COOH + 2Al → 2[CH3CH(OH)COO]3Al + 3H2.
In particolare, quando l’Alluminio è presente sotto forma di idrossido:
3CH3CH(OH)COOH + Al(OH)3 → [CH3CH(OH)COO]3Al + 3H2O
Nei farmaci, il lattato di alluminio è utilizzato come principio attivo per il trattamento delle irritazioni e delle infezioni superficiali minori delle mucose del cavo oro-faringeo.
C9H15AlO9 LD50 = 540 mg/kg peso corporeo nei conigli
Alluminio citrato C6H5AlO7 - Si ottiene facendo reagire l’Alluminio con l’acido citrico:
2C3H4OH(COOH)3 + 2Al → 2[C3H4OH(COO)3]Al + 3H2
Come l’acetato, l’alluminio citrato ha proprietà astringenti e asettiche e viene somministrato per via topica. Diversi studi sulla neurotossicità sono stati eseguiti su ratti nelle prime settimane di vita, in particolare sul loro comportamento dopo assunzione orale costante di citrato di alluminio per diverse settimane, ma non ci sono ancora interpretazioni univoche circa i rischi associati.
Alluminio: contenuto totale di tutti i suoi composti presenti negli alimenti.
L’analisi chimica di molti alimenti consente di riscontrare tenori diversi di Alluminio totale in essi “naturalmente” presenti.
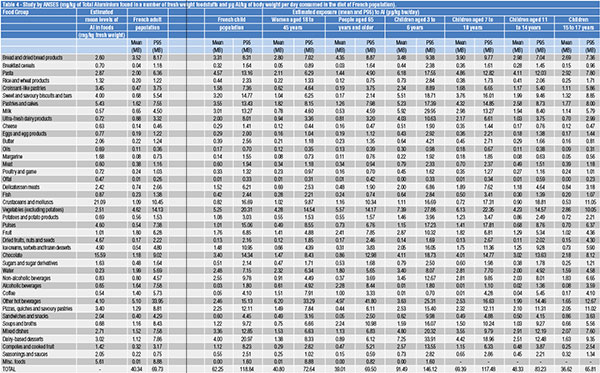
Nella tabella 4 si riportano alcuni dati tratti da uno studio francese eseguito da ANSES (French Agency for food, environmental and occupational health & safety) [6] ove vengono riportati i mg/kg di Alluminio totale contenuto in diversi alimenti pesati freschi e i µg Al/kg peso corporeo al giorno ingeriti nella dieta dalla popolazione francese, così suddivisa:
- adulti (media);
- bambini (media);
- donne di età compresa tra i 18 e i 45 anni;
- persone di età pari o superiore a 65 anni;
- bambini di età compresa tra i 3 e i 6 anni;
- bambini di età compresa tra i 7 e i 10 anni;
- bambini di età compresa tra gli 11 e i 14 anni;
- ragazzi di età compresa tra i 15 e i 17 anni.
IN CONCLUSIONE
L’ossido di Alluminio, che naturalmente si forma sulla superficie a contatto con l’aria con cinetiche rapide, è protettivo in certi range di pH. Per pH molto acidi (<4) o basici (>8.7) l’ossido non riesce da solo a proteggere il metallo dalla corrosione e, con meccanismi diversi a seconda della sostanza (ad esempio: cloruro di sodio o acido acetico generano pitting, acido citrico e lattico generano corrosione filiforme ai bordi dei grani), ioni Al+3 vanno in soluzione.
Tuttavia, questi ioni reagiscono in parte con i complessanti presenti nello specifico alimento formando ossidi, idrossidi e sali.
Un’analisi di “migrazione o rilascio”, effettuata con tecniche di assorbimento atomico, ICP valuta l’alluminio totale, che è soprattutto quello presente sotto forma di composti.
Per valutare la reale esposizione della popolazione non si può prescindere dall’eseguire un’analisi che, partendo da una dieta di riferimento, valuti (per fascia di età, sesso e abitudini alimentari che possono essere diverse da Paese a Paese) la quantità di Al totale già presente negli alimenti e vi aggiunga quella “migrata” dal packaging metallico.
Solo ricerche effettuate seguendo questi criteri possono attestare in modo attendibile se sono rispettati i limiti suggeriti dall’EFSA in merito all’assunzione di Al totale nella dieta.
Anche prove di migrazione o rilascio con liquidi non possono essere significative, in quanto non rappresentano il reale contatto dell’alimento con il supporto metallico.
Ovviamente, per liquidi fortemente acidi c’è da aspettarsi la corrosione dell’alluminio con valori di migrazione prossimi a quelli indicati nel lavoro sperimentale sopra riportato; fenomeno che peggiora notevolmente in caso di elevate temperature e/o tempi di esposizione superiori alle 24 ore.
L’Italia, con il DM 76 del 18/04/2007, ha dato direttive precise a riguardo, inducendo i produttori a fornire ai consumatori chiare istruzioni d’uso: un produttore italiano di alluminio o di suoi oggetti, destinati al contatto con alimenti, non può esimersi dallo scrivere le condizioni d’uso previste dal Decreto, limitando così rischi per la salute per sovra-esposizione attraverso la dieta.
Tra l’altro le indicazioni che il DM 76 prescrive di apporre sulle confezioni di vendita per vaschette e foglio in alluminio sono state concepite dal Legislatore in un linguaggio semplice, non tecnicistico, per consentire una facile e immediata comprensione da parte del consumatore.
Sarebbe stato auspicabile che l’approccio legislativo usato dall’Italia fosse stato recepito e applicato anche da altri Paesi europei, che non hanno alcuna normativa specifica (ad eccezione della Francia che ha un datato Arrêté du 27 août 1987).
L’approccio usato da BfR [3] è molto discutibile: qualsiasi imballo utilizzato in maniera indiscriminata, può indurre migrazione eccessiva di sostanze dall’imballo all’alimento (immaginate un recipiente plastico usato a temperature di gran lunga superiore a quelle previste per il suo utilizzo quante sostanze farebbe migrare nell’alimento).
Lo stesso Nehring Institut, accreditato e noto centro di ricerca tedesco che è stato sempre un riferimento europeo nel food-contact, ha espresso perplessità sull’approccio usato dal BfR. [9]
Ciro Sinagra
Laminazione Sottile Group, Caserta (I)
| BIBLIOGRAFIA
[1] P. Dumas, J. Dubarry-Barbe, D. Rivière, Yves Levy, J. Corset - “Growth of thin alumina film on aluminium at room temperature: a kinetic and spectroscopy study by surface plasmon excitation”, Journal de Physique Colloques, 1983 |