Tracciabilità e dispositivi biomedicali: la svolta UE
I sistemi integrati di ispezione, codifica e marcatura per il mercato dei dispositivi biomedicali sono stati il focus di un seminario formativo organizzato il 12 ottobre da Nimax (leader in Italia in materia di codifica e marcatura) e dalla bresciana Antares Vision (fornitore globale di sistemi di ispezione visiva, tracciatura e gestione intelligente dei dati).
Nella location di Villa Quaranta (VR), dopo gli interventi dei promotori dell’iniziativa per presentare lo stato dell’arte del settore, si sono avvicendati esperti di realtà di primo piano, come GS1, Romaco e Warrant Group, che hanno spiegato ai rappresentanti delle principali aziende del comparto medicale i requisiti previsti dalle nuove direttive europee, consigliando come affrontare le problematiche di natura tecnica, organizzativa e amministrativa.
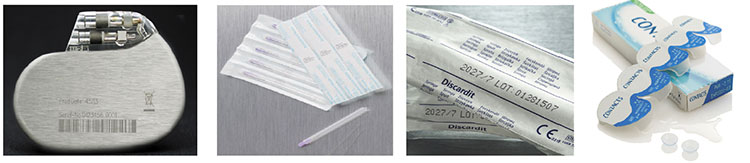
Il pubblico ha dimostrato particolare interesse a comprendere i diversi aspetti della normativa, dalle problematiche di marcatura e tracciabilità sul packaging, all’obbligo di implementare la codifica UDI su ciascun prodotto medicale venduto o distribuito all’interno dell’UE. Occorre, però, tener presente che, ad oggi, quest’ultimo requisito non può ancora essere soddisfatto dal 70% delle linee di produzione attive sul mercato, e che il tempo medio di attrezzaggio perché una linea sia conforme è di oltre 12 mesi. Nondimeno, con l’entrata in vigore delle nuove normative UE Medical Device Regulation (EU MDR), produttori e distributori di dispositivi medici hanno l’obbligo legale di garantire, entro la fine di maggio del 2020, che un codice UDI (più qualsiasi altra informazione obbligatoria contenuta nell’Annex VI Part B del regolamento) sia assegnato e registrato in EUDAMED* per ogni singolo articolo prodotto.
Glossario normativa UE Medical Device Regulation (EU MDR)
UDI: codice numerico o alfanumerico univoco che deve essere apposto su ogni dispositivo medico, etichetta o packaging e deve essere in un formato leggibile sia dall’uomo (solo testo alfanumerico) che dalle macchine (codici a barre o datamatrix).
Il codice UDI è composto da due parti:
1. Identificativo del Dispositivo (UDI-DI). Identifica la versione o il modello specifico di un prodotto (Obbligatorio e Fisso).
2. Identificativo della Produzione (UDI-PI). È variabile e può contenere uno o più delle seguenti informazioni:
• Numero di lotto o batch ove il dispositivo è stato prodotto
• La data di scadenza di uno specifico dispositivo
• Il serial number se richiesto per specifici dispositivi.
* EUDAMED è il database europeo sui dispositivi medici. Il suo scopo è rafforzare la sorveglianza del mercato e la trasparenza nel settore dei dispositivi medici, fornendo alle autorità nazionali competenti un rapido accesso alle informazioni.




















